Як Плазмові білки називаються білками плазми крові. Вони відрізняються від сироваткових білків насамперед факторами згортання. Білки плазми беруть на себе численні завдання в організмі і можуть впливати на симптоми дефіциту в умовах різних захворювань.
Що таке білки плазми?
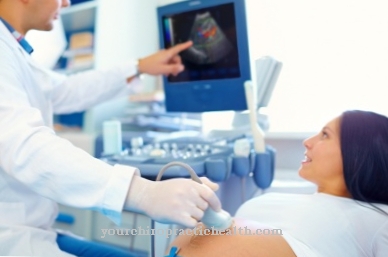
Медичний працівник розуміє, що білки плазми крові є білками плазми крові, також відомими як Білок крові позначаються. Плазма відрізняється від сироватки крові за факторами її згортання, які також належать до білків плазми. Всього в плазмі крові міститься близько ста різних білків і глікопротеїнів. Білки становлять приблизно шість-вісім грам на 100 мілілітрів плазми крові. Термін сироватковий білок слід відрізняти від білків плазми.
Сироваткові білки - це всі білки крові за вирахуванням фактора згортання фібриногену. Білки плазми можуть розщеплюватися на альбуміни та глобуліни за допомогою електрофорезу. Це означає, що білки в плазмі крові, як заряджені колоїдні частини або молекули, поділяються на альбуміни та глобуліни, коли вони мігрують через електричне поле. Ці дві групи присутні в плазмі приблизно в співвідношенні від 40 до 60 відсотків.
Анатомія та структура
Глобуліни є або α1-, α2-, γ- або β-глобулінами. Електрофоретична рухливість цих чотирьох підгруп є їх основною відмітною ознакою. На додаток до приблизно чотирьох відсотків α1 глобулінів, плазма містить також близько восьми відсотків α2 глобулінів і дванадцять відсотків β глобулінів. Γ-глобуліни складають найбільшу частку плазми крові - 16 відсотків. Біосинтез білків плазми відбувається переважно в печінці та лімфі.
Що стосується глікопротеїнів, то трансляція відбувається через посттрансляційну модифікацію. Залишки глікозилу в своїй активній формі зв'язуються з нуклеозиддифосфатом. Вони зв'язують глікозил-трансферази з білками. Як і всі білки, білки плазми є біологічними макромолекулами, що складаються з амінокислот. Клобулярні білки майже сферичні за четвертинною або третинною структурою. Більше 100 амінокислот пов'язані з утворенням ланцюгів у білках. Білки в плазмі крові також відомі як сфероїдні білки. Їх легко розчинити у воді та сольовому розчині.
Функція та завдання
Плазмові білки беруть на себе різні завдання в організмі людини. З одного боку, вони підтримують колоїдний осмотичний тиск, що, в свою чергу, відіграє роль у підтримці об’єму плазми. Значення рН крові підтримується також білками плазми. Крім цього, білок крові має транспортну функцію. Вони транспортують у воді нерозчинні речовини через організм, тому їх також називають білками-носіями.
Транспорт гормонів та ферментів відбувається також на білки-носії плазми крові. Плазмові білки, такі як фібриноген, які допомагають при гомеостазі, особливо незамінні для згортання крові. Крім того, білки плазми беруть на себе важливі завдання в процесах імунної системи, наприклад при запаленні. У цьому контексті ми також говоримо про імуноглобуліни або антитіла, які утворюються у відповідь на антигени. Імуноглобуліни розпізнають чужорідні тіла і зв’язуються з цими антигенами, щоб знищити їх. До глобулінів α1 в першу чергу входить транскортин, який відповідає за транспорт стероїдів. Α1-антитрипсин пригнічує протеазу. Те саме стосується α1-антихімотрипсину. Білок плазми HDL є білком-носієм для ліпідів крові.
Протромбін діє як проензим тромбіну, а транскобаламін транспортує кобаламін через кров. До глобулінів α2 входить гаптоглобін, який зв’язує і транспортує гемоглобін. α2-макроглобулін та α2-антитромбін пригнічують згортання крові, тоді як церулоплазмін транспортує мідь. Трансферрин, який відповідає за транспортування заліза, є одним з β-глобулінів. β-ліпопротеїн транспортує ліпіди крові, тоді як фібриноген відомий як фактор згортання крові. Гемопексин є кінцевим β-глобуліном і зв’язує вільний гем. Імуноглобуліни належать до п’ятої групи глобулінів, компоненти якої також відомі як γ-глобуліни.
Хвороби
При диспротеїнемії відбуваються зрушення в кількісному співвідношенні білків крові. Це явище може бути як вродженим, так і набутим. Набута диспротеїнемія може бути викликана, наприклад, гострими інфекціями. У цьому випадку частка альбумінів зменшується, а частка глобулінів збільшується. Це явище може виникнути і при великих втратах крові або після операції. Необхідно розрізняти ці придбані форми диспротеїнемії, вродженого порушення розподілу, як це стосується дефіциту альфа-1-антитрипсину.
Через генетичний дефект виробляється занадто мало альфа-1-антитрипсину. У разі генетичного дефіциту окремих білків плазми також говорять про білкову дефектність. Слід розрізняти це і парапротеїнемію. У рамках цього захворювання все частіше формуються певні імуноглобуліни або ланцюги імуноглобулінів. Такі процеси трапляються, наприклад, на тлі хвороби Вальденстрема. Це злоякісне захворювання лімфоми, при якому клітини лімфоми перепродують імуноглобулін М. Існує також надмірна концентрація імуноглобулінів при множинній мієломі. При цьому раку кісткового мозку клітини, що продукують антитіла, розмножуються в плазмі крові.
Ці вироджені плазматичні клітини продукують надлишок антитіл або фрагментів антитіл. У зв’язку з білками плазми може виникати як гіпопротеїнемія, так і гіперпротеїнемія. У першому концентрація білків плазми падає нижче 66 грам на літр. З іншого боку, при гіперпротеїнемії концентрація перевищує 83 грами на літр. Причиною гіпопротеїнемії може бути, наприклад, ураження печінки або неправильне харчування. Гіперпротеїнемія, з іншого боку, зазвичай пов'язана із запальними процесами і може виникати, наприклад, на тлі туберкульозу.




.jpg)