Складні клітинні та фізіологічні процеси у живих істот потребують тонко налаштованої регуляції на молекулярному рівні, щоб забезпечити пристосованість тварини чи рослини, наприклад, до середовища проживання. Для цього існують численні молекули, які втручаються в такі процеси, як клітинний зв’язок, метаболізм або поділ клітин. Однією з цих молекул є білок Кальмодулінякий за допомогою кальцію впливає на функцію багатьох інших біологічно активних білків.
Що таке кальмодулін?
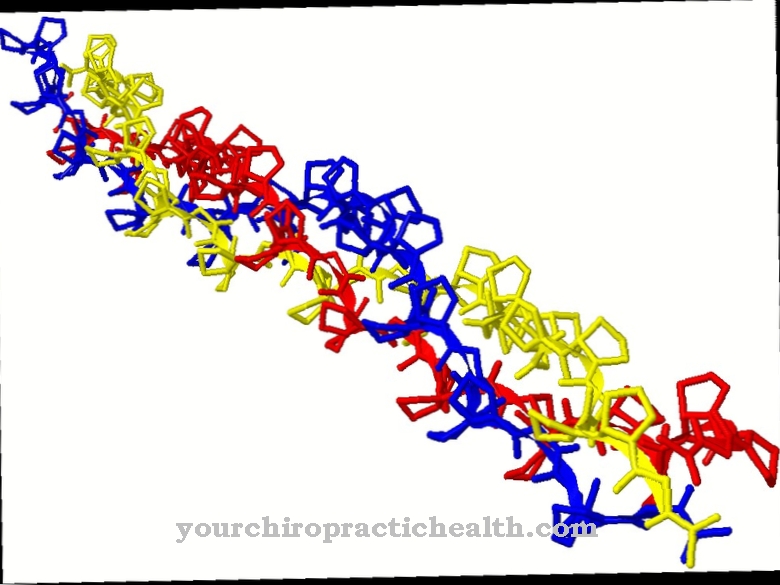
Кальмодулін - внутрішньоклітинний регуляторний білок, який зв’язує іони кальцію. За своєю будовою він належить до групи білків EF-рук. Форма кальмодуліну, що складається з 148 амінокислот і становить 6,5 нм, нагадує гантелі. Молекулярна маса цієї молекули білка становить близько 17 кДа.
Через свою біологічну функцію в передачі сигналу всередині клітин кальмодулін також можна класифікувати як другий месенджер, тобто вторинну речовину месенджера, яка, однак, сама по собі не є ферментативно активною. У двох сферичних областях білка є два мотиви спіралі-петлі-спіралі на відстані 1,1 нм, до яких можна зв’язати загалом чотири іони кальцію. Ця структура відома як рука EF. Структури рук EF пов'язані водневими зв’язками між антипаралельними бета-листами кальмодуліну.
Функція, ефект та завдання
Кальмодуліну потрібно три-чотири зв'язані іони кальцію на одну молекулу, щоб бути активними. В активованому стані утворюється кальцієво-кальмодуліновий комплекс бере участь у регуляції великої кількості рецепторів, ферментів та іонних каналів з найрізноманітнішими функціями. Регульовані ферменти включають фосфатазний кальциневрин, який відіграє важливу роль у регуляції імунної відповіді, та ендотеліальну синтазу оксиду азоту (eNOS), яка виробляє NO, який, крім усього іншого, використовується для розслаблення гладкої мускулатури. Кровоносні судини.
При низьких концентраціях кальцію аденілатциклаза (АС) також активується, при високих концентраціях кальцію, з іншого боку, ферментативний аналог, фосфодіестераза (ФДЕ). Таким чином досягається хронологічна послідовність регуляторних механізмів: спочатку AC змінює шлях сигналу через виробництво циклічного AMP (cAMP), пізніше це знову відключається противником PDE через деградацію cAMP. Однак регуляторний вплив кальмодуліну на білкові кінази, такі як Санакіназа II або міозинова кіназа легкої ланцюга (MLCK), що буде пояснено більш докладно нижче, особливо відомий.
CAMKII може зв'язувати залишки фосфату з різними білками і тим самим впливати на енергетичний обмін, проникність для іонів і вивільнення нейромедіаторів з клітин. CAMKII виявляється в особливо високих концентраціях в мозку, де він відіграє важливу роль у пластичності нейронів, тобто. всі процеси навчання. Але кальмодулін також незамінний для рухових процесів. У спокої концентрація іонів кальцію в м’язовій клітині дуже низька, і тому кальмодулін неактивний. Однак, якщо м'язова клітина порушена, кальцій надходить у плазму клітини і, як кофактор, займає чотири місця зв'язування кальмодуліну.
Тепер це може активувати міозинову кінозу легкої ланцюга, яка зміщує скорочувальні волокна в клітині і, таким чином, забезпечує скорочення м'язів. Іншими, менш відомими ферментами, які перебувають під впливом кальмодуліну, є гуанілатциклаза, Са-Mg-АТФаза та фосфоліпаза А2.
Освіта, виникнення, властивості та оптимальні значення
Кальмодулін зустрічається у всіх еукаріотів, до яких належать усі рослини, тварини, гриби та група амебоїдних істот. Оскільки молекула кальмодуліну в цих організмах зазвичай структурується відносно подібним чином, можна припустити, що це еволюційно дуже старий білок, який з’явився на ранній стадії.
Як правило, кальмодулін присутній у відносно великих кількостях у плазмі клітини. Наприклад, в цитозолі нервових клітин звичайна концентрація становить близько 30-50 мкМ, тобто 0,03-0,05 моль / л. Білок утворюється під час транскрипції та трансляції з використанням гена CALM, з яких є три відомі на сьогоднішній день алелі, які називають CALM-1, CALM-2 та CALM-3.
Хвороби та розлади
Існують деякі хімічні речовини, які можуть надавати інгібіторну дію на кальмодулін, тому відомі як інгібітори кальмодуліну. У більшості випадків їх інгібуюча дія ґрунтується на тому, що вони транспортують кальцій із клітини і таким чином виводять його з кальмодуліну, який тоді присутній лише в неактивному стані.
Ці інгібуючі речовини включають, наприклад, W-7. Крім того, деякі психотропні фенотіазинові препарати інгібують кальмодулін. Настільки широкі, як регуляторні функції кальмодуліну, настільки різноманітними є можливі дефекти та порушення, коли білок вже не може активуватися кофактором кальцію, а самі регульовані цільові ферменти є менш активними. Наприклад, неадекватна активація CAMKII може призвести до обмеження нейронної пластичності, що є основою для процесів навчання.
Зниження активації MLCK погіршує скорочення м'язів, що може призвести до порушень руху. Менша активація ферменту кальциневрину через дефіцит кальмодуліну впливала б на імунну відповідь організму і менша активація еНО призведе до зниження концентрації NO. Останнє в основному викликає проблеми, коли в іншому випадку оксид азоту повинен запобігати небажаному згортанню крові та розширювати судини для кращого кровообігу. Однак у цьому моменті слід також зазначити, що датчик кальцію Часелін може за певних умов перебирати біологічні функції кальмодуліну і таким чином замінювати молекулу.

.jpg)











.jpg)