Структурні білки служать головним чином будівельниками розтягу в клітинах і тканинах. Зазвичай вони не мають ферментативної функції, тому зазвичай не втручаються в обмінні процеси. Структурні білки зазвичай утворюють довгі волокна і дають z. В. зв’язки, сухожилля і кістки, їх міцність і рухливість, їх рухливість. Кілька різних типів структурних білків становлять близько 30% усіх білків, що зустрічаються у людини.
Що таке структурний білок?
Білки, які в основному надають тканині свою структуру та стійкість до розриву, підсумовуються під терміном структурні білки. Структурні білки характеризуються тим, що вони зазвичай не беруть участь у ферментативно-каталітичних обмінних процесах.
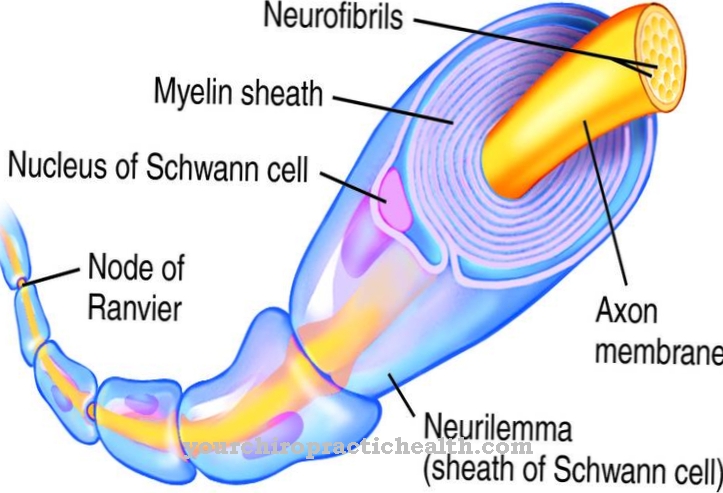
Склеропротеїни, які зараховуються до структурних білків, зазвичай утворюють молекули довгих ланцюгів у вигляді з’єднаних разом амінокислот, кожна з яких пов'язана між собою за допомогою пептидних зв'язків. Структурні білки часто мають повторювані амінокислотні послідовності, що дозволяють молекулам мати особливі вторинні та третинні структури, такі як подвійні або потрійні спіралі, що призводить до особливої механічної міцності. Важливими та відомими структурними білками є z. Б. Кератин, колаген і еластин. Кератин - це один із структурних білків, що утворюють волокна, які надають структурі шкірі (епідермісу), а також волоссю та нігтям.
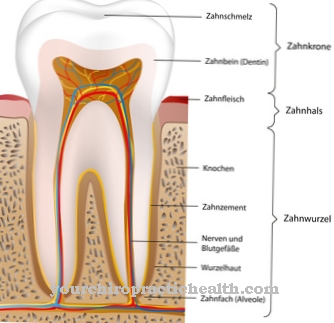
Маючи понад 24% усіх білків, що містяться в організмі людини, колагени утворюють найбільшу групу структурних білків. Що вражає колагенів, це те, що кожна третя амінокислота є гліцином і послідовність гліцин-пролін-гідроксипролін накопичується. Колагени, стійкі до сліз, є найважливішими компонентами кісток, зубів, зв’язок і сухожиль (сполучна тканина). На відміну від колагенів, які важко розтягнути, еластин надає певним тканинам можливість розтягуватися. Тому еластин є важливим компонентом в легенях, в стінках судин і в шкірі.
Функція, ефект та завдання
Різні класи білків підпадають під термін структурний білок. Усі структурні білки мають спільне те, що їх основна функція полягає в наданні структури та міцності тканині, в якій вони знаходяться. Потрібен широкий спектр необхідних структурних властивостей. Колагени, які утворюють структурний білок в зв’язках і сухожиллях, надзвичайно стійкі до сліз, оскільки зв’язки і сухожилля піддаються великим навантаженням з точки зору стійкості до розриву.
Як складова в кістках і зубах, колагени також повинні бути здатні утворювати зламостійкі структури. Крім стійкості до розриву, інші тканини тіла потребують особливої еластичності, щоб адаптуватися до відповідних умов. Структурні білки, що належать до групи еластинів, виконують це завдання. Вони можуть бути розтягнутими і в обмеженій мірі порівнянні з еластичними волокнами тканини. Еластини дозволяють швидко регулювати об'єм судин, легенів та різних шкір та оболонок, які обволікають органи і мають справлятися зі зміною розмірів органів. У шкірі людини колагени та еластини доповнюють один одного, щоб забезпечити як стійкість, так і здатність рухати шкіру.
Хоча колагени в зв’язках і сухожиллях головним чином гарантують міцність на розрив у певному напрямку, кератини, що входять до складу нігтів і нігтів, повинні забезпечувати рівну (двовимірну) міцність. Інший клас структурних білків складається з так званих рухових білків, які є основним компонентом м’язових клітин. Міозин та інші рухові білки мають здатність скорочуватися за рахунок певного нервового подразника, завдяки чому м’яз тимчасово скорочується при використанні енергії.
Освіта, виникнення та властивості
Структурні білки, як і інші білки, синтезуються в клітинах. Обов’язковою умовою є забезпечення запасу відповідних амінокислот. По-перше, кілька амінокислот пов'язані з утворенням пептидів і поліпептидів. Ці частини білка з'єднуються на шорсткому ендоплазматичному ретикулумі, щоб утворювати більші частини, а потім утворювати повну молекулу білка.
Структурні білки, які повинні виконувати функції поза клітинами в позаклітинному матриксі, мітяться і транспортуються у позаклітинний простір шляхом екзоцитозу за допомогою секреторних пухирців. Необхідні властивості структурних білків охоплюють широкий спектр між міцністю на розрив та еластичністю. Структурні білки зазвичай трапляються лише у складі тканин, так що їх концентрацію неможливо легко виміряти. Оптимальна концентрація тому не може бути задана.
Хвороби та розлади
Складні завдання, які повинні взяти на себе різні структурні білки, призводять до того, що також можуть виникнути збої в роботі, які призводять до розладів і симптомів. Це також може призвести до збоїв в роботі ланцюга синтезу, оскільки для синтезу потрібна велика кількість ферментів і вітамінів.
Найбільш помітні порушення виникають, коли відповідні білки неможливо синтезувати через недостатність амінокислот. Більшість необхідних амінокислот може синтезуватися самим організмом, але не ті незамінні амінокислоти, які потрібно приймати ззовні у вигляді їжі або харчових добавок. Навіть при достатньому запасі незамінних амінокислот всмоктування в тонкому кишечнику може бути порушене через хвороби або через потрапляння в організм токсинів або як побічну дію певних препаратів і викликати дефіцит. Відомим, хоча і рідкісним, захворюванням у цьому контексті є м’язова дистрофія Дюшенна.
Хвороба викликається генетичним дефектом на Х-хромосомі, тому безпосередньо уражаються лише чоловіки. Генетичний дефект означає, що структурний білковий дистрофін, який відповідає за закріплення м’язових волокон скелетних м’язів, не може бути синтезований. Це призводить до важкої м’язової дистрофії. Ще одне - теж рідкісне - спадкове захворювання призводить до мітохондріопатії. Кілька відомих генетичних дефектів всередині ДНК та мітохондріальної ДНК можуть спричинити мітохондрії. Змінений склад певних структурних білків мітохондрій призводить до зменшення енергозабезпечення для всього організму.





.jpg)
.jpg)



.jpg)