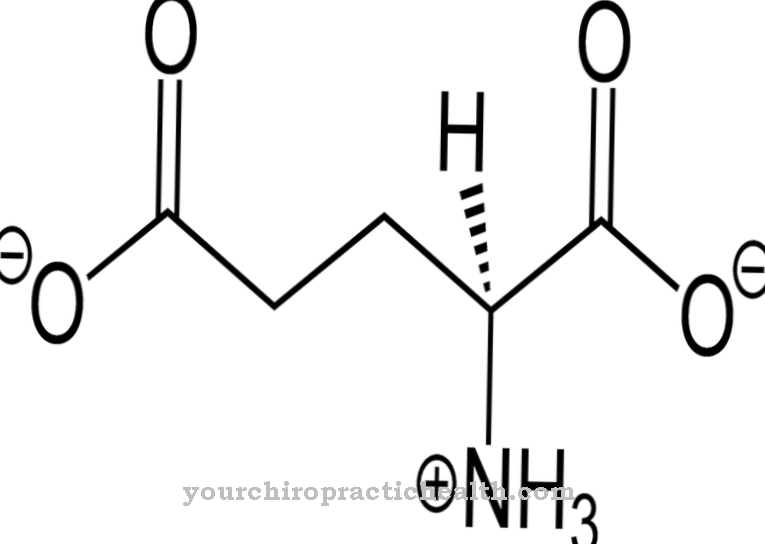
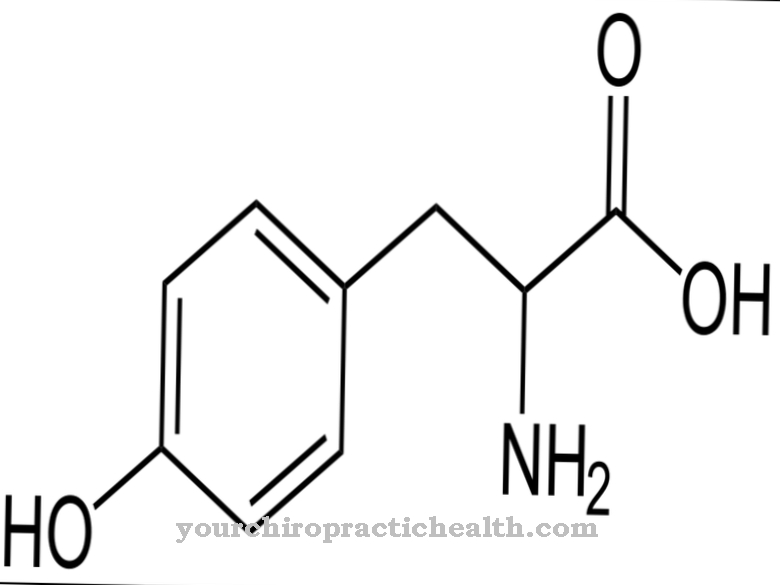
Гідроксилізин є некласичною протеїногенною амінокислотою. Він включається у відповідний білок як лізин і гідролізується до гідроксилізину в межах поліпептиду за допомогою ферменту. Це один з основних компонентів білків колагену в сполучній тканині.
Що таке гідроксилізин?
Гідроксилізин - протеїногенна амінокислота, яка спочатку включається в білок як лізин. Тому це неканонічна протеїногенна амінокислота. Термін "канонічний" означає класичний.
Так що кодону для цієї амінокислоти немає. Гідроксилізин в основному міститься в колагені сполучної тканини та в глікопротеїнах. Там лізин перетворюється на гідроксилізин за допомогою ферментативних процесів. Лише частина лізину перетворюється на гідроксилізин. Властивості відповідних колагенів залежать від кількості гідролізованих залишків лізину та проліну.
Гідроксилізин може бути виділений у вільній формі у вигляді гідрохлориду. Гідрохлорид гідроксилізину - це бежевий порошок із температурою плавлення, що становить від 225 до 230 градусів. Це основна амінокислота, яка також змушує білки, що містять гідроксилізин, реагувати основними. Гідроксилізин виявив американський біохімік і співзасновник "Клінічної хімії" Дональд Ван Слейк (1883-1971).
Функція, ефект та завдання
Гідроксилізин має велике значення для структури сполучної тканини. Глікопротеїни також містять гідроксилізин для того, щоб утворювати глікозидні сполуки білка з залишками цукру на гідроксильному залишку.
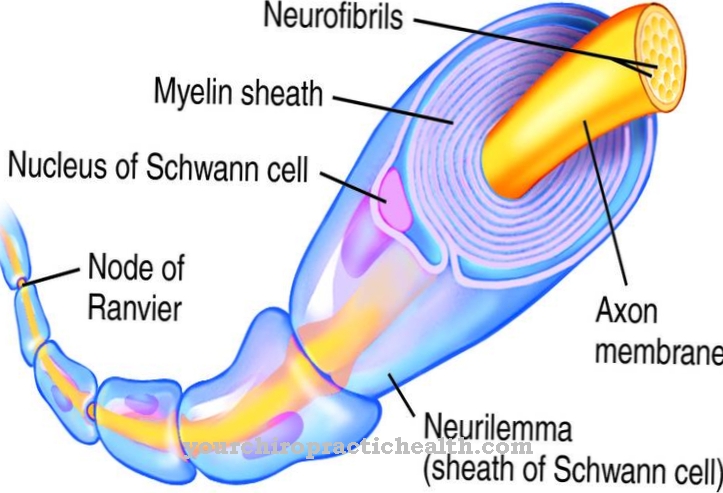
У межах колагену він відповідає за зшивання окремих молекул білка. Разом з гідроксилпроліном, гідролізованою формою проліну, він також сприяє побудові третинної та четвертинної структур колагену. Гідроксилювання лізину каталізується ферментом лізил гідроксилази за участю кофакторів іонів заліза та аскорбінової кислоти (вітамін С). Схема розподілу гідроксильованих залишків лізину в колагені не є ні особливо жорсткою, ні гнучкою. Завжди є повторювані закономірності.
Однак у білку також є цілі області, які не містять гідроксильованих залишків лізину. Хоча гідроксипролін відповідає за спіральну структуру колагену через зв'язування трьох білкових ланцюгів, перехресні зв’язки між різними молекулами білка утворюються через гідроксильні групи гідроксилізину. Крім того, ці молекулярні групи також служать місцем зв'язування глікозидної зв'язку з цукром. В цілому це забезпечує міцність сполучної тканини.
Якщо в білках є дефіцит гідроксилізину, це не може бути усунено додатковим прийомом амінокислоти. Не існує кодону для вільного гідроксилізину, так що він не може бути включений у відповідний білок. Значення дієтичних добавок з доданим гідроксилізином є дуже сумнівним. Тому дефіцит повинен бути обумовлений недостатньою гідроксиляцією лізину.
Освіта, виникнення, властивості та оптимальні значення
Гідроксилізин міститься лише в колагені людини і тварин. Також є деякі глікопротеїни, які також містять гідроксилізин. Сюди входить адипонектин. Адипонектин - гормон, який виробляється в жировій тканині і має вирішальний вплив на ефективність інсуліну. Гідроксилізин виявлено також у деяких бактерій, таких як золотистий стафілокок.
Розподіл гідроксильованого лізину в колагені неоднаковий. Є місця, де його майже завжди можна знайти. В інших районах гідроксилізин майже не зустрічається. Цей нерівномірний розподіл визначає структуру колагену. У межах потрійної спіральної структури колагену гідроксилізин завжди розташований у положенні Y повторюваної послідовності Gly-X-Y. У коротких регіонах з не-спіральною структурою гідроксилізин трапляється і в інших місцях.
Хвороби та розлади
Сполучна тканина абсолютно залежить від наявності гідроксилізину. Колаген може бути стабільним і твердим, лише якщо взаємозв'язки білкових молекул працюють. Дефіцит гідроксилізину викликає слабкість сполучної тканини.
Якщо він присутній лише в надзвичайно малих кількостях або взагалі його немає, відповідний організм не був би життєздатним. Сполучна тканина вже не могла виконувати завдання як обмежувальну і підтримуючу тканину для органів. Насправді, існують захворювання, які можна відстежити через брак гідроксилізину. Оскільки ця амінокислота спочатку включається як лізин під час синтезу білка, це не може бути первинним дефіцитом. Гідроксилізин утворюється з лізину всередині білка колагену за допомогою лізил гідроксилази. Дефіцит гідроксилізину може бути наслідком лише дефекту цього ферменту або його недостатньої функції.
Існує група різнорідних вроджених слабких сполучних тканин, яка відома як синдром Елерса-Данлоса. Ряд мутацій може бути відповідальним за цю клінічну картину. Крім усього іншого, лізил гідроксилаза також може бути дефектною, так що занадто мало лізину гідроксилюється. Синдром Елера-Данлоса проявляється через перенапруженість шкіри та пересушування суглобів. Також уражаються внутрішні органи, судини, сухожилля, зв’язки та м’язи. Прогноз залежить від вираженості дефекту. Якщо судна задіяні, слід очікувати несприятливого ходу. Повна недостатність ферменту лізил гідроксилаза несумісна з життям і тому не спостерігається.
Але навіть при інтактному ферменті може бути слабкою сполучною тканиною через низьку активність. Лізил гідроксилаза потребує іонів заліза та аскорбінової кислоти (вітамін С) як кофакторів. Якщо, наприклад, не вистачає вітаміну С, виникає те, що відомо як цинга. Шкурка - це набуте захворювання сполучної тканини, викликане нестачею гідроксильних груп на пролінових та лізинових залишках колагену. Причиною є низька активність пролін гідроксилази та лізин гідроксилази через дефіцит аскорбінової кислоти.



.jpg)



.jpg)
.jpg)



.jpg)