The Водневий зв’язок це взаємодія між молекулами, що нагадує взаємодії Ван дер Ваальса і відбувається в організмі людини. Зв'язок відіграє особливу роль, особливо у зв'язку з пептидними зв'язками та ланцюгами амінокислот у білках. Без здатності зв'язуватися з водневими зв’язками організм не життєздатний, оскільки йому не вистачає життєво важливих амінокислот.
Що таке водневий зв’язок?

Водневі зв’язки називаються Водневі зв’язки або Н мости скорочено. Це хімічний ефект, який стосується привабливої взаємодії ковалентно пов'язаних атомів водню з вільними електронними парами атома, що групує атом. Взаємодія заснована на полярності і, більш точно описано, складається між позитивно поляризованими атомами водню в аміно- або гідроксильній групі та одинокими парами електронів інших функціональних груп.
Взаємодія відбувається лише за певних обставин. Однією умовою є електронегативна властивість вільних пар електронів. Ця властивість повинна бути сильнішою від електронегативної властивості водню, щоб створити міцний зв’язок. Таким чином, атом водню може бути пов'язаний полярним. Електронегативно вільними атомами можуть бути, наприклад, азот, кисень та фтор.
Водневі зв’язки - це вторинні валентні зв’язки, сила яких зазвичай набагато нижче сили ковалентних зв'язків або іонних зв’язків. Молекули у водневих зв’язках мають відносно високу температуру плавлення і аналогічно високу температуру кипіння по відношенню до їх молярної маси. Зв'язки мають медичне значення насамперед стосовно пептидів та нуклеїнових кислот в організмі.
Водневі зв’язки - це міжмолекулярні сили. Без їх існування вода не існувала б у різних агрегатних станах, але була б газоподібною.
Функція та завдання
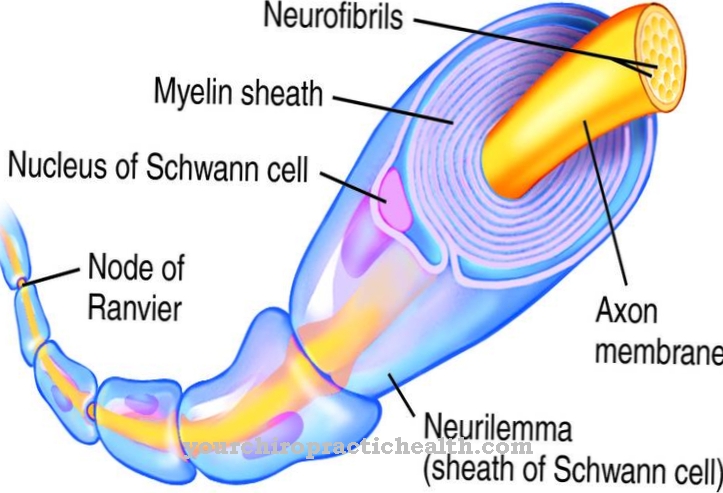
Водневий зв’язок має лише слабку взаємодію і відбувається між двома частинками або всередині молекул. У цьому контексті тип зв’язку відіграє роль, наприклад, для утворення третинних структур у білках. У біохімії структура білка означає різні структурні рівні білка або пептиду. Структури цих природних речовин ієрархічно поділяються на первинну структуру, вторинну структуру, третинну структуру та четвертинну структуру.
Послідовність амінокислот є первинною структурою. Щоразу, коли згадується білок щодо його просторового розташування, часто називають білкові конформації та явище змін конформації. У цьому контексті зміна конформації відповідає зміні просторової структури. Розташування білків ґрунтується на пептидному зв’язку. Цей тип зв’язків завжди однаково з’єднує амінокислоти.
У клітинах пептидні зв’язки опосередковуються рибосомами. Кожному пептидному зв’язку відповідає з'єднання карбоксильних груп однієї амінокислоти та аміногрупи другої амінокислоти, яке пов'язане з виведенням води. Цей процес також відомий як гідроліз.
У кожному пептидному зв’язку одинарна зв'язок з'єднує C = O групу з NH групою. Атом азоту має рівно одну самотню пару електронів. Через високу електронегативність кисню ця вільна пара перебуває під впливом атомів O2, що відводить електрон. Таким чином кисень частково втягує одиноку пару електронів у зв’язок між атомом азоту та атомом вуглецю, а пептидний зв’язок набуває часткового подвійного зв'язку. Характер подвійного зв'язку виключає вільне обертання NH та C = O груп.
Атоми кисню та атоми водню пептидних зв'язків мають значення для формування структури всіх без винятку пептидів та білків. Таким чином дві амінокислоти можуть прикріплюватися одна до одної. Після такого приєднання всі пептидні зв’язки двох ланцюгів амінокислот знаходяться прямо один проти одного. Атоми водню в пептидному зв’язку відносно позитивно поляризовані порівняно з атомами кисню у прямо протилежних пептидних зв’язках. Таким чином водневі зв’язки утворюють і з'єднують два ланцюги амінокислот один з одним.
Всі амінокислоти в організмі людини є органічними сполуками, що складаються щонайменше з однієї карбоксигрупи та однієї аміногрупи. Амінокислоти є важливим структурним компонентом життя людини. Крім α-амінокислот білків відомо більше 400 непротеїногенних амінокислот з біологічними функціями, які не могли б утворитися без водневого зв’язку. Такі сили, як водневий зв’язок, стабілізують третинну структуру амінокислот.
Ви можете знайти ліки тут
➔ Ліки від м’язової слабкостіХвороби та недуги
Якщо є порушення у формуванні функціональних білково-ергічних просторових структур, зазвичай говорять про захворювання білкових складок. Одним із таких станів є хвороба Хантінгтона. Цей генетичний розлад успадковується як аутосомно-домінантна ознака і обумовлений генетичною мутацією в хромосомі 4. Мутація призводить до нестабільності генного продукту. Хвороба - це неврологічне захворювання, яке в першу чергу пов'язане з мимовільним гіперкінезом дистальних кінцівок і обличчя. Постійний гіперкінез призводить до ригідності в уражених м’язах. Крім того, пацієнти із захворюванням страждають від підвищеного споживання енергії.
Патологічні симптоми у зв’язку з водневими зв’язками або загальною структурою білка також присутні в прионних захворюваннях, таких як хвороба божевільної корови. Згідно з найпопулярнішою гіпотезою, BSE викликає неправильне згортання білків. Ці неправильно згорнуті білки не можуть бути розбиті фізіологічними процесами і тому накопичуються в тканині, особливо в центральній нервовій системі. Результатом є дегенерація нервових клітин.
Порушення структури білка також обговорюються в причинному зв'язку хвороби Альцгеймера. Зазначені захворювання безпосередньо не впливають на водневий зв’язок, але стосуються просторової структури білків, до якої водневий зв’язок вносить значний внесок.
Організм з абсолютною нездатністю до водневої зв'язку не є життєздатним. Мутація, що спричиняє це, призведе до аборту на ранніх термінах вагітності.







.jpg)
.jpg)



.jpg)