Лізил оксидаза є ферментом сполучної тканини, який має каталітичні завдання та сприяє зшиванню колагену та еластину. Фермент надає стабілізуючу дію на сполучну тканину, проводячи окисне дезамінування і тим самим створюючи основні умови для зшивання. У Cutis laxa активність лізилоксидази знижується.
Що таке лізилоксидаза?
В організмі людини є різні ферменти, всі вони мають каталітичну активність. Ферменти вмикають реакції в організмі людини або прискорюють їх. Лізилоксидаза - фермент, який знаходиться в сполучній тканині людини. Його ще називають білковою лізин 6 оксидазою і знаходиться переважно в позаклітинному просторі сполучної тканини.
Каталітична активність ферменту в цьому випадку відноситься до зшивання між колагеном і еластином. Лізил оксидаза механічно стабілізує два білки і тим самим забезпечує реакційне з'єднання. Лізил оксидаза знаходиться не тільки в організмі людини. Інші хребетні також забезпечені ферментом. Лізил оксидаза вважається стабілізатором сполучної тканини. Дефіцит ферменту призводить до клінічної картини cutis laxa, вираженої та спадкової слабкості сполучної тканини.
Функція, ефект та завдання
Лізил-оксидаза бере на себе важливі завдання у позаклітинному просторі при поперечному зв’язку між окремими молекулами колагену. В організмі людини колаген відіграє головну роль у складі білків, при цьому складає близько 30 відсотків загальної білкової маси.
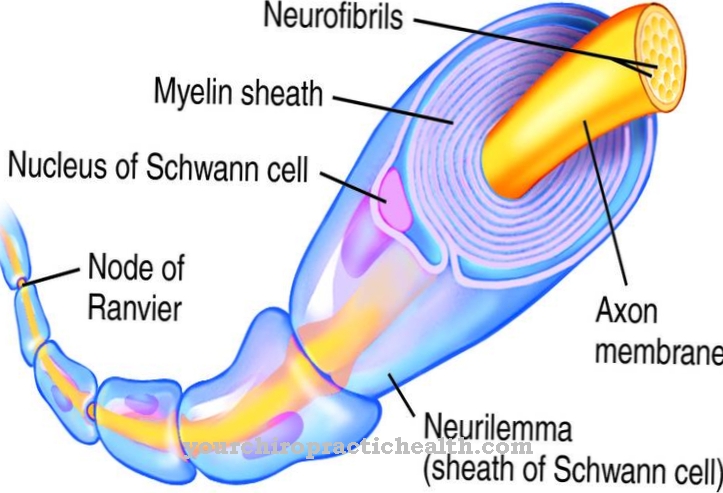
Колаген - найпоширеніший білок. Це структурний і будівельний білок, який складається з багатьох частин тіла, таких як сполучна тканина, кістки, зуби, хрящі, сухожилля, зв’язки та шкіра. Лізилоксидаза підтримує зв'язування колагену з карбонільними групами і тим самим сприяє стабільності згаданих компонентів організму. Він має каталітичну активність для отримання карбонільних груп, які утворюють ковалентні поперечні зв язки на колагенах в альдольній конденсації. Отже, каталітичне завдання лізил оксидази полягає в підготовці до утворення фібрил. Фермент створює всі хімічні умови, необхідні для утворення.
Фібрилами вважаються волокна волокна. Вони відповідають тонким і волокнистим частинам тіла і знаходяться в клітинних стінках рослин, в м’язах людини і в сполучній тканині. Завданням лізилоксидази в цьому контексті є, по суті, окислювальне дезамінування залишків лізилу. У хімії дезамінація - це хімічне розщеплення аміногруп як іонів амонію або аміаку. Окислювальне дезамінування розщеплює аміногрупи амінокислоти L-глутамат з водню та окислює їх до іміногруп з переносом водню до НАД + або НАДФ +.
Після цього відбувається гідролітичне розщеплення іміногруп як іонів амонію, що пов'язано з утворенням α-кетокислоти. Дезамінація відповідає першому етапу біохімічного розпаду амінокислот, який у ссавців відбувається переважно в печінці. Іон амонію, що утворюється при дезамінації, перетворюється на сечовину. Процеси дезамінування лізил оксидази породжують альдегідні групи, які з окремими аміногрупами інших залишків лізилу створюють так звані основи Шиффа і таким чином можуть утворювати стабілізуючі поперечні зв’язки колагену.
Освіта, виникнення, властивості та оптимальні значення
Лізил оксидаза в ДНК кодується геном LOX, який у людини розташований на хромосомі 5 у локусі гена q23.3 до q31.2. Генний продукт не є кінцевою формою ферменту. Продукт не є готовою лізилоксидазою, а попередньою формою, яка після перекладу має молярну масу 47 кДа.
У подальшому перебігу відбувається глікозилювання. Під час цього процесу молярна маса пізнього ферменту збільшується до 50 кДа, а попередня форма лізилоксидази виділяється у позаклітинний простір. Після секреції попередню про-лізил оксидазу обробляють далі. Речовина розщеплюється у позаклітинному просторі. Білок 1 відповідає за розщеплення на два фрагменти. Таким чином, з одного боку, утворюється 32 кДа лізил оксидаза. З іншого боку, створюється залишкова речовина, яка в даному випадку відповідає поліпептиду.
Хвороби та розлади
Генетичні дефекти лізилоксидази можуть спричинити клінічну картину кутікс-лаксу. Це захворювання також називають дерматохалазом і відноситься до групи часто вікових слабкостей сполучної тканини, які в більшості випадків спостерігаються при сімейному скупченні.
Спільною характеристикою всіх явищ дерматохалазу є провисання та нееластична шкіра, яка часто звисає великими складками на різних ділянках тіла. Більшість постраждалих виглядають старшими, ніж вони через зміни. Захворювання викликаються, серед іншого, генетичними мутаціями. У цьому контексті ми говоримо про синдром cutis laxa. Захворювання може існувати в аутосомно-рецесивній, аутосомно-домінантній та х-хромосомній формах. У багатьох випадках синдром cutis laxa асоціюється з іншими аномаліями, і, якщо органи задіяні, наприклад, може бути летальним.
ARCL1 відповідає cutis laxa аутосомно-рецесивного типу 1 і вважається найбільш важкою формою, яка може призвести до небезпечних для життя ускладнень. Форма ARCL1A пов'язана з мутаціями гена FBLN5 в локусі 14q32.12. Тип ARCL1B асоціюється з мутаціями в гені EFEMP2 в локусі 11q13.1, а варіант ARCL1C відповідає лакісі cutis із супутніми аномаліями в легенях, шлунково-кишковому тракті та сечовивідних шляхах, які зумовлені мутаціями гена LTBP4 в локусі 19q13.2.
Мутації в згаданих генах призводять до нижчої середньої активності ліксилоксидази. Неадекватні перехресні зв’язки створюються завдяки зниженій активності ферменту. Сполучна тканина пацієнта недостатньо стабілізується.


.jpg)
.jpg)



.jpg)



.jpg)