Трипсин Як фермент підшлункової залози, він відповідає за подальше розщеплення харчових білків. Він працює в сильно лужному діапазоні. Дефіцит трипсину призводить до дефіциту білка в організмі через порушення травлення білка.
Що таке трипсин?
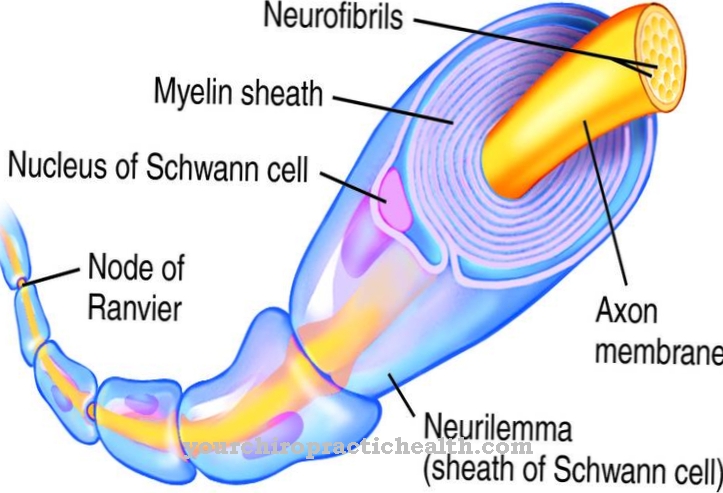
Трипсин - протеаза, яка продовжує розпад білків в лужному відділі тонкої кишки. У шлунку починається розпад білка в кислому середовищі ферментом пепсином. Фермент трипсин складається з трьох компонентів.
Це трипсин-1 як катіон, трипсин-2 як аніон і трипсин-4. Дві третини ферменту складаються з трипсину-1 і третина трипсину-2. Трипсин-4 або мезотрипсин міститься лише в невеликій кількості. Трипсин - ендопротеза. Він лише розщеплює білок в певних місцях. Це також серинова протеаза. Його активний центр містить каталітичну тріаду аспарагінової кислоти, гістидину та серину. Він розщеплює дієтичні білки переважно на основні амінокислоти лізин, аргінін та модифікований цистеїн.
Трипсин виробляється з попередника цимогену трипсиногену за допомогою каталітичної дії кишкового ферменту ентеропептидази. Фермент складається з 224 амінокислот. Трипсин розвиває свій оптимальний ефект при значенні pH від 7 до 8.
Функція, ефект та завдання
Завдання трипсину - продовжити розщеплення білків, що вже почалося в шлунку, в лужному діапазоні. У шлунку починається попереднє перетравлення харчових білків аналогічним ферментом пепсину в кислому діапазоні.
Тут теж білкові ланцюги розбиваються в певні моменти. Хоча це розщеплення білків відбувається в шлунку на ароматичні амінокислоти, такі як фенілаланін, протеїни та поліпептиди розщеплюються трипсином на основні амінокислоти лізин та аргінін, а також на модифікований цистеїн. Ще одна відмінність пепсину полягає в тому, що трипсин розвиває свій оптимальний ефект у лужному діапазоні при значенні pH від 7 до 8. Активований трипсин також перетворює інші зимогени, такі як хімотрипсиноген, проеластаза, прокарбоксипептидаза та інші неактивні ферменти, в активні ферменти.
Конверсія починається відразу після вивільнення трипсину. Інші протеази підшлункової залози - хімотрипсин, карбоксипептидаза або еластин. Крім того, трипсин активує себе шляхом перетворення трипсиногену. Ферменти підшлункової залози спочатку знаходяться в неактивній формі, щоб не руйнувати підшлункову залозу шляхом самотравлення. Тільки тоді, коли неактивні заготовки секретуються, їх можна активувати розщепленням. Перш за все, перетворення трипсиногену в трипсин каталізується ентеропептидазою. Це єдина функція ентеропептидази.
Гексамер з кінцевою амінокислотою лізином відокремлюється від трипсиногену. Оскільки трипсин також розщеплює поліпептидні ланцюги на основний лізин, він також каталізує власну активацію і одночасно активацію інших цимогенів. Разом з ферментами хімотрипсином та еластазою він розщеплює більші білки в тонкому кишечнику та пептони (поліпептидні ланцюги), що утворюються під дією пепсину на три- та дипептиди. Ці менші пептиди розщеплюються далі на амінокислоти за допомогою інших ферментів. Зокрема, трипсин також сприяє розщепленню амінокислоти метіоніну. Лізин стимулює, серед іншого, утворення трипсину.
Освіта, виникнення, властивості та оптимальні значення
Трипсин - ендогенний фермент, який використовується для перетравлення харчових білків. Ось чому він завжди виділяється підшлунковою залозою незабаром після їжі. Однак фермент також може бути отриманий з тваринних джерел і використаний медикаментозно. Ефект розщеплення білка може бути використаний, серед іншого, для руйнування власних білкових комплексів організму. Ось як можна усунути імунні комплекси при аутоімунних захворюваннях.
Запалення в опорно-руховій системі також можна добре лікувати трипсином. Він також активує фермент плазмін із плазміногену. Плазмін розчиняє фібрин при сильному утворенні тромбів. Тромбоз можна лікувати або навіть запобігти за допомогою трипсину. Трипсин також підтримує травлення під час прийому їжі. Якщо його застосовувати за 1 - 2 години до їжі або після неї, це розвиває її протизапальну дію.
Хвороби та розлади
В умовах недостатності підшлункової залози синтез травних ферментів, таких як трипсин, може бути обмежений. Наслідок - розвиток травлення. Крім протеаз, підшлункова залоза виробляє також ліпази та амілази.
Якщо ферментів бракує, харчові компоненти більше не засвоюються і потрапляють у товсту кишку. Наприклад, якщо не вистачає трипсину, білок в раціоні вже не може бути належним чином засвоюється. Гнильні бактерії осідають у товстому кишечнику і розщеплюють білки анаеробно. Виникають масові проблеми з травленням з метеоризмом, діареєю та болем у животі. Крім того, зменшене утворення амінокислот призводить до дефіциту білка і неправильного харчування, незважаючи на достатнє споживання їжі. Однак ферменти також можуть надходити ззовні.
Однак є також медичні випадки, коли власні ферменти організму, такі як трипсин, перетравлюють саму підшлункову залозу. Це може статися, якщо жовчні та панкреатичні протоки заблоковані. Трипсин вивільняється, але не може потрапити в тонкий кишечник через закупорку підшлункової залози. Якщо панкреатична протока не буде відкрита в цій гострій надзвичайній ситуації, результат буде летальним через саморозчин підшлункової залози. Навіть при пухлинах підшлункової залози підшлункова протока може бути повністю або частково закрита. Дія травних соків всередині підшлункової залози проявляється хронічним або гострим панкреатитом.
Нестача трипсину також може бути викликана мутацією. Крім того, існують також спадкові форми панкреатиту при порушенні розпаду трипсину.





.jpg)
.jpg)



.jpg)