The Ентеропептидаза є ферментом слизової дванадцятипалої кишки, функцією якого є активація ферментів підшлункової залози. Це стоїть на початку цілого каскаду активації травних ферментів. Дисфункція ентеропептидази призводить до неправильного засвоєння та неправильного всмоктування їжі в тонкому кишечнику.
Що таке ентеропептидаза?
Ентеропептидаза - фермент слизової дванадцятипалої кишки, який активує травні ферменти підшлункової залози шляхом активації трипсиногену до трипсину.
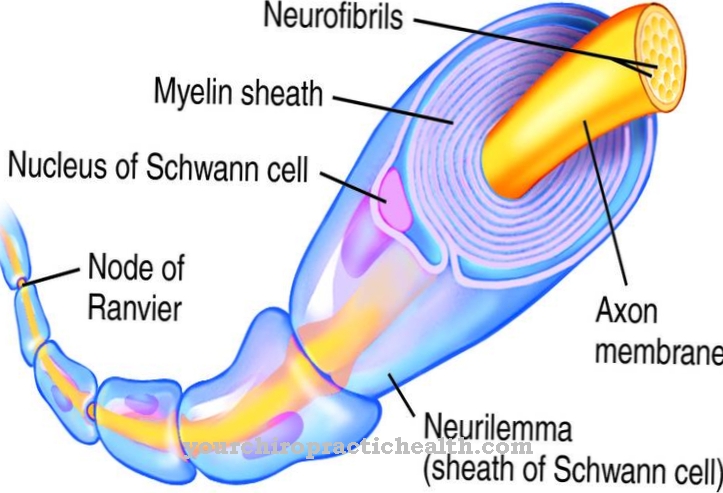
Ентеропептидаза секретується в щітковій рамці слизової дванадцятипалої кишки. Зокрема, залози лебекюна відповідають за секрецію. Залози Лейбекюна - це трубчасті западини в епітелії тонкого та товстого кишечника. У тонкому кишечнику вони розташовуються між ворсинками тонкого кишечника. Залози, також відомі як крипти Ліберкюна, виділяють велику кількість ферментів, крім ентеропептидази. Секреція ентеропептидази стимулюється, коли хім, попередньо перетравлений у шлунку, потрапляє у дванадцятипалу кишку. Сам фермент не впливає на харчові компоненти.
Тільки активація ферменту трипсину приводить у рух весь каскад активації травних ферментів. Ентеропептидаза, як трипсин та інші протеази підшлункової залози, є сериновою протеазою. Активний центр містить каталітичну тріаду аспарагінової кислоти, гістидину та серину. Як ендопептидаза, ентеропептидаза розщеплює білки лише у певних характерних точках з певними мотивами розпізнавання в послідовності амінокислот. Фермент завжди розщеплюється за мотивом розпізнавання Asp-Asp-Asp-Asp-Lys. За допомогою трипсиногену гексапептид Val- (Asp) 4-Lys розщеплюється, при цьому утворюється трипсин.
Функція, ефект та завдання
Функція ентеропептидази полягає в активації травних ферментів підшлункової залози. Він лише ініціює перший етап активації з перетворенням трипсиногену в трипсин.
Трипсин, в свою чергу, є сериновою протеазою, яка розщеплює білки за тим же характерним мотивом розпізнавання. Зараз триває активація самого трипсиногену. У той же час він активує інші ферменти підшлункової залози з відповідних їх попередників, такі як хімотрипсиноген, проеластаза, прокарбоксипептидаза, профосфоліпаза та проентеропептидаза. Ентеропептидаза також спочатку знаходиться в неактивній формі. Коли химус потрапляє в дванадцятипалу кишку, виділяється не тільки проентеропептидаза, а й дуоденаза, що активує проформ ентеропептидази. Після початку каскаду активації трипсин бере на себе активацію всіх ферментів підшлункової залози, включаючи проентеропептидазу та трипсиноген.
Активація проентеропептидази до ентеропептидази відбувається навіть більш ефективно через дію трипсину, ніж через дуоденазу. Вкрай важлива первинна присутність травних ферментів у їх неактивній формі. Дія протеаз, зокрема, не є специфічною. Усі білки, що містять характерний мотив розпізнавання всередині молекули, гідролітично розщеплюються. Якби ферменти були негайно каталітично активними, власні білки організму вже перетравлювалися б у підшлунковій залозі та підшлунковій протоці. В результаті підшлункова залоза розчинилася б сама. Активація відбувається лише в дванадцятипалій кишці поза екзокринними залозами.
Ензими можуть почати тут розщеплювати харчові компоненти, не атакуючи власні тканини організму. Щоб запобігти активації ферментів передчасно, в протоці підшлункової залози працює додатковий інгібітор трипсину. Однак ключову роль для травного каскаду відіграє трипсин. Після активації цього ферменту неможливо зупинити активацію всіх травних ферментів, включаючи ентеропептидазу.
Освіта, виникнення, властивості та оптимальні значення
Як і всі серинові протеази, ентеропептидаза також має неспецифічну дію і розщеплює білки, використовуючи характерний мотив розпізнавання. Ентеропептидаза складається з легкої і важкої ланцюга, які пов'язані дисульфідними мостами. Домен серинової протеази розташований на легкій ланцюзі.
Важка ланцюг має молекулярну масу від 82 до 140 кілодальтонів, при цьому молекулярна маса легкого ланцюга становить від 35 до 62 кілодальтонів. Структура легкої ланцюга ентеропептидази схожа з іншими сериновими протеазами трипсином та хімотрипсином. Важка ланцюг пов'язана з мембраною і впливає на специфічність ферменту. Було встановлено, що ізольована легка ланцюг має аналогічну дію щодо характерного мотиву розпізнавання - (Asp) 4-Lys-, але значно менший ефект проти трипсиногену.
Хвороби та розлади
Ентеропептидаза людини кодується геном ENTK на хромосомі 21. Мутація цього гена може призвести до серйозних захворювань у уражених дітей.
Фермент більше не може активувати інші травні ферменти. Компоненти їжі більше не руйнуються і тому більше не можуть засвоюватися тонким кишечником. Це насамперед питання неправильного засвоєння (недостатнього розпаду), що призводить до мальабсорбції харчових компонентів. Організм вже не достатньо забезпечений поживними речовинами. Якщо не процвітає, виникають затримки росту і типові симптоми дефіциту білка з розвитком набряку. У той же час, крім білків, вуглеводи та жири погано засвоюються. Оскільки неперетравлені харчові компоненти досягають товстого кишечника і там розщеплюються за рахунок бродіння та гнильних бактерій, також виникає метеоризм, діарея та біль у животі.
Поки в світі описано 15 випадків вродженої недостатності ентеропептидази. Однак симптоми захворювання набагато частіше зустрічаються. Дефіцит ентеропептидази не завжди повинен бути присутнім. Оскільки трипсин відіграє ключову роль в активізації травних ферментів, дефект або дефіцит трипсину також призводить до подібних симптомів. Лікування цих захворювань в обох випадках однакове. Ферменти вводять в активованій формі. Звичайно, існує ще багато недіагностованих випадків дефіциту ентеропептидази.
Якщо діагноз визначений, ентеропептидазу також можна замінити. Дефіцит ентеропептидази також вдруге викликається важкими кишковими захворюваннями.Такі захворювання, як целіакія, укорочена тонка кишка, лактазна недостатність або інші, повинні бути уточнені в диференційному діагнозі.

.jpg)



.jpg)
.jpg)



.jpg)