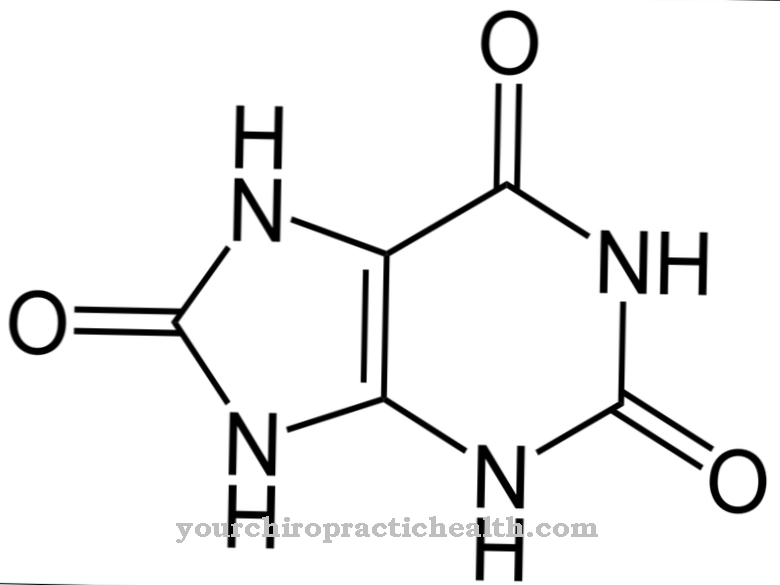
Десмосін є протеїногенною амінокислотою. Разом з іншими амінокислотами він утворює волокна та структурний білок еластин. При мутаціях гена ELN порушується структура еластину.
Що таке десмосин?
Амінокислоти - важлива частина людського організму. Вони є класом органічних сполук, які утворюються щонайменше з однієї карбоксильної групи та однієї аміногрупи. Тому амінокислоти - це як карбонові кислоти, так і аміни.
Залежно від їх положення стосовно карбокси групи, амінокислоти можуть бути віднесені до різних груп. Амінокислоти з кінцевою карбоксигрупою називаються гемінальними або α і відносяться до числа α-амінокислот. Ці амінокислоти є елементами білків. Організм людини має понад 20 протеїногенних амінокислот та 400 непротеїногенних амінокислот. D-амінокислоти - це особлива група. Однією з більш ніж 20 протеїногенних амінокислот є десмозин, який разом з аналогічно побудованим ізодесмозином утворює білок волокна еластин.
Еластин та його розчинний попередник тропоеластин належать до структурних білків і сприяють формуванню та утриманню анатомічних структур. Еластин відіграє особливу роль у здатності великих кровоносних судин до розтягування, наприклад аорти.
Функція, ефект та завдання
Десмозин формально є чотириразовою амінокислотою. Він має піридінієве кільце в центрі. Піридин - хімічна сполука з емпіричною формулою C5H5N, яка може бути віднесена до гетероциклічної материнської системи і утворює найпростіший азин у вигляді шестичленного кільця з одним атомом азоту та п'ятьма атомами вуглецю.
Завдяки своєму центральному піридінієвому кільцю, дезмозин може з'єднати окремі білкові нитки в білковому еластині білка. Склад еластину аналогічний складу колагену. Однак замість гідроксилізину еластин має значну частку валіну. Залишки лізину окислюються до аллізину ферментом лізилоксидазою. Три аллізину і один лізин в свою чергу утворюють десмозин у вигляді кільця. Ця форма відіграє значну роль у еластичності цілої молекули еластину.
Як білкова мережа, еластин складається з пов'язаних з десмозином одиниць і еластично розтягується. Легені, а також шкіра та судини залежать від еластину та його компонента десмосину, оскільки це єдиний спосіб отримати значну еластичність. Десмозин флуоресцентно синій під ультрафіолетовим світлом і надає еластину жовтий колір, його нерозчинність у воді, термостійкість та стійкість до лугів та протеаз.
Освіта, виникнення, властивості та оптимальні значення
Утворення десмозину також відоме як біосинтез десмозину. Під час цього біосинтезу кінцеві аміногрупи L-лізинних одиниць перетворюються на ω-альдегіди ферментом лізилоксидазою шляхом окислення.
Лізилоксидаза є білковою лізином 6 оксидазою і, таким чином, відповідає ферменту, який знаходиться у позаклітинному просторі сполучної тканини. У зшиванні еластину та колагену він служить каталізатором і механічним стабілізатором білків. Під час біосинтезу дезмозину лізилоксидаза перетворює лізин в аллізин. Цей процес відбувається у позаклітинному матриксі і стабілізує перехресні зв’язки між колагеном та еластином. З хімічної точки зору реакція відповідає окислювальному дезамінуванню з утворенням альдегіду. Алізин утворює або алісінальдол, або десмозин з залишками альдегідів сусідніх молекул тропеластину через альдолову конденсацію.
Залишився лізин утворює основу Шиффа через свою аміногрупу і створює ізодесмозин. Окрім кровоносних судин, легенів та шкіри, всі мікрофібрили зокрема несуть десмозин. Це найдрібніші волокна колагенної, ретикулярної та еластичної тканини.
Хвороби та розлади
Утворення еластину з таких компонентів, як десмозин, порушується при різних захворюваннях. Ці захворювання насамперед включають мутації в гені ELN. Найважливіші з них - дерматохалаз, синдром Вільямса-Берена та вроджений аномальний аортальний підщелепний стеноз. Дерматохалаз - це група змін сполучної тканини з сімейним накопиченням.
Для цієї групи характерне провисання, менш еластична і зморшкувата шкіра на різних ділянках тіла. Ген ELN кодує еластин і може викликати такі симптоми через мутацію. Синдром Вільямса-Берена досить рідкісний порівняно з цим, він вражає лише одного з 20 000 новонароджених. Захворювання викликане дефектом на сім'ї хромосоми. Локус гена - 7q11.23. Через дефект у цій точці ураженій людині не вистачає гена еластину та сусідніх генів. Видалення гена еластину викликає дисморфізм обличчя та розлади у внутрішній структурі органів. Серцеві дефекти, такі як надключебний аортальний стеноз та вади нирок, такі як нирковий підкова або стеноз ниркового судин. Крім того, часто спостерігається когнітивна інвалідність.
Розумові здібності постраждалих нижче середнього. Незважаючи на словесну виразність, вони переважно утворюють речення з невеликим змістом. Вони починають читати в надзвичайно ранньому віці, що часто завищує їх розумові здібності. Окрім гіперлексичної ситуації, їх ідеальний крок часто призводить до завищень. Як форма мутації еластину, субвалвулярний вроджений аортальний стеноз відповідає, у свою чергу, порокам серця, пов'язаним із звуженням основної артерії. Надклапанний стеноз лежить над аортальним клапаном на початку аорти.
Ця форма пороку серця часто характеризується звуженнями у формі пісочного годинника, що лежать над випускним отвором коронарних судин. Зростаюча частина аорти також може бути звужена. Ця форма аортального стенозу зустрічається особливо часто в контексті щойно обговорюваного синдрому Вільямса-Берена. Цю ваду серця вже спостерігали незалежно від захворювання. У цьому випадку, однак, це не обов'язково має бути пов'язано з мутацією гена еластину.


.jpg)

.jpg)



.jpg)
.jpg)



.jpg)