Біля Рятувальний шлях з продуктів розпаду біомолекул синтезується нова біомолекула. Шлях врятування також відомий як шлях відновлення і є, так би мовити, формою переробки в метаболізмі.
Який шлях врятування?
Шлях ушкодження стосується загальної форми цієї переробки в метаболізмі, з одного боку, і метаболічного шляху пуринових нуклеотидів, з іншого. Пуринові нуклеотиди є основними хімічними будівельними блоками дезоксирибонуклеїнової кислоти (ДНК) та рибонуклеїнової кислоти (РНК).
У спасінні нуклеотидів путин монунуклеотиди утворюються з пуринових основ гуаніну, аденіну та гіпоксантину. На 90% цей метаболічний шлях є основним метаболічним шляхом для вільних пуринів. Решта розщеплюється на сечову кислоту. Шлях врятування пропонує численні переваги, особливо порівняно з біосинтезом de novo мононуклеотидів пурину. Наприклад, це значно енергоефективніше.
Анатомія та структура
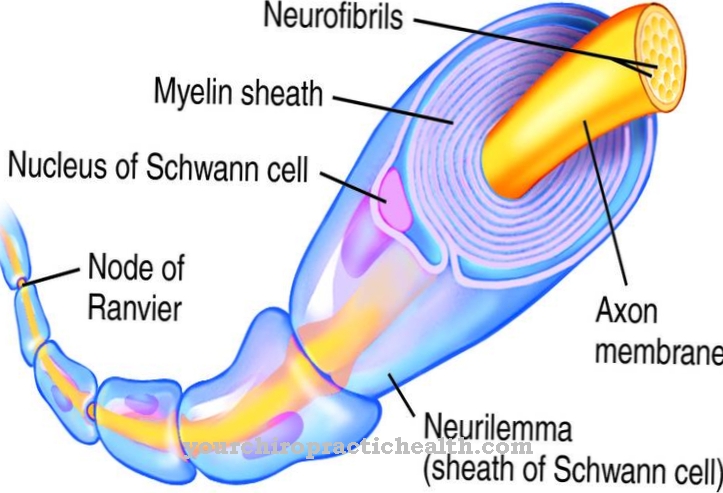
Синтез біциклічних пуринових основ передбачає багато зусиль для організму. Тому їх розбивають на прості основи, а потім знову використовують.
На шляху рециркуляції різні проміжні продукти розпаду мононуклеотидів, нуклеозидів, полінуклеотидів або основ нуклеїнової кислоти використовуються для побудови реакцій замість того, щоб повністю їх руйнувати. Завдяки реакції шляху врятування, корисні та цінні проміжні продукти метаболізму, так звані метаболіти, можуть бути врятовані від утилізації. Тож ці метаболіти не потрібно виробляти знову. Цей процес економить клітину високим споживанням енергії. У шляху врятування фосфат рибози з фосфорибозилпірофосфату (PRPP) переноситься у вільну пуринову основу.
Нуклеотид утворюється шляхом відщеплення пірофосфату. Ензими, необхідні для цього, активуються фосфорибозилпірофосфатом та інгібуються кінцевими продуктами. З пуринової основи аденину утворюється монофосфат аденозину (AMP) разом з (PRPP) і за допомогою ферменту аденіну фосфорибозил-трансферази (APRT). У зв'язку з PRPP та ферментом гіпоксантин-гуанін-фосфорибосілтрансферазою (HGPRT) гуанін стає монофосфатом нуклеотиду гуанозину (GMP). З PRPP та ферментом гіпоксантин-гуанін-фосфорибосілтрансфераза гіпоксантин стає нуклеотидним монофосфатом інозину (ІМП).
Іншими ферментами, які беруть участь у шляху врятування, є нуклеозидні фосфорилази, нуклеозидні кінази та нуклеотидні кінази. 90% пуринів спочатку перетворюються на нуклеотиди, а потім знову використовуються для синтезу нуклеїнових кислот шляхом перетворення. 10% пуринів розпадаються на сечову кислоту і виводяться через нирки.
Функція та завдання
Шлях врятування відбувається майже у всіх клітинах організму, оскільки пурини розщеплюються майже на всі клітини організму. Пурини належать до групи гетероциклів і поряд з піримідинами є найважливішими будівельними блоками нуклеїнових кислот. Пурини утворюються за допомогою самого шляху врятування. Вони містяться у всіх клітинах, які мають ядро.
Їжа тваринного походження, особливо субпродукти та шкіра, містять багато пуринів. Пурини, які не переробляються шляхом врятування, розпадаються на сечову кислоту і виводяться через нирки. Немає значення крові для шляху спасіння, але є для сечової кислоти. У чоловіків рівень сечової кислоти в крові зазвичай становить від 3,4 до 7,0 мг / 100 мл. У жінок значення сечової кислоти має бути між 2,4 і 5,7 мг / л.
Хвороби
Якщо в шляху врятування є дефект, пурини вже не можна переробляти. Значно більше пуринів розщеплюється, так що утворюється більше сечової кислоти. Нирки вже не здатні повністю виводити сечову кислоту, що призводить до гіперурикемії.
Гіперурикемія - це підвищення рівня сечової кислоти в крові. За визначенням, гіперурикемія присутня від рівня сечової кислоти 6,5 мг / дл. Граничне значення відноситься однаково до обох статей. Підвищення рівня сечової кислоти через порушення шляху врятування також відоме як первинна гіперурикемія. Близько 1% всієї гіперурикемії викликається надвиробництвом сечової кислоти через порушення в метаболізмі пурину. Більшість первинних гіперурикемій базується на зниженій екскреції сечової кислоти в нирки.
Для того, щоб розрізнити, чи базуються підвищені показники сечі на зниженій екскреції або на збільшенні вироблення сечової кислоти, слід визначити кліренс сечової кислоти. Для обчислення кліренсу сечової кислоти визначають виділення сечової кислоти в 24-годинному збиранні сечі та сечову кислоту в сироватці крові.
У більшості випадків гіперурикемія залишається безсимптомною. У разі масивної гіперурикемії виникає гострий напад подагри. Саме тут кристалізовані солі сечової кислоти відкладаються в суглобах. Це призводить до запалення в уражених суглобах з перегрівом, болем і сильним почервонінням. Особливо часто уражаються плюснефаланговий суглоб, гомілковостопний суглоб і колінний суглоб. Якщо подагра зберігається тривалий час, тканина переробляється. Хрящ в суглобах потовщується і розвиваються так звані подагричні тофі.
Генетичним дефектом, який призводить до гіперурикемії, є синдром Леша-Ніхана. Захворювання успадковується рецесивним шляхом, пов'язаним з Х, і призводить до дефіциту ферменту гіпоксантин-гуанін-фосфорибосілтрансферази (HGPRT). Оскільки фермент бере участь у пуриновому обміні пуринових основ гіпоксантину та гуаніну, для деградації утворюється більше пуринів. Результат - різке підвищення сечової кислоти. Хвороба успадковується в X-зв’язаному вигляді. Ось чому синдром Леша-Найхана страждає майже виключно на чоловіків. Перші симптоми з’являються приблизно через десять місяців після народження.
Діти виявляють помітну позицію в поєднанні з малорухливим способом життя та дефіцитом розвитку. Перша ознака - часто підвищений залишок сечі в пелюшці. У важких випадках можуть траплятися і самопошкодження, такі як укуси губ і пальців, і порушення мислення. Постраждалі діти можуть також вести себе агресивно по відношенню до батьків, братів і сестер, друзів або опікунів.





.jpg)
.jpg)



.jpg)