Міозин належить до рухових білків і відповідає, крім усього іншого, за процеси, що беруть участь у скороченні м’язів. Існують різні типи міозинів, всі вони беруть участь у транспортних процесах клітинних органел або в змінах всередині цитоскелету. Структурні відхилення в молекулярній структурі міозину можуть за певних обставин бути причиною м'язових захворювань.
Що таке міозин?
Поряд з динеїном та кінезином, міозин є одним з рухових білків, які відповідають за процеси руху клітин і транспортні процеси всередині клітини. На відміну від двох інших рухових білків, міозин працює лише з актином. Актин, у свою чергу, входить до складу цитоскелету еукаріотичної клітини. Тому він відповідає за структуру і стабільність клітини.
Крім того, актин з міозином та двома іншими структурними білками утворюють фактичну скоротливу структурну одиницю м’яза. Дві третини скоротливих білків у м’язах - міозини, а третина - актин. Однак міозини присутні не тільки в м’язових клітинах, але і у всіх інших еукаріотичних клітинах. Це стосується одноклітинних еукаріотів, а також рослинних і тваринних клітин. Мікрофіламенти (актинові нитки) беруть участь у структурі цитоскелету у всіх клітинах і разом з міозином контролюють протоплазматичні струми.
Анатомія та структура
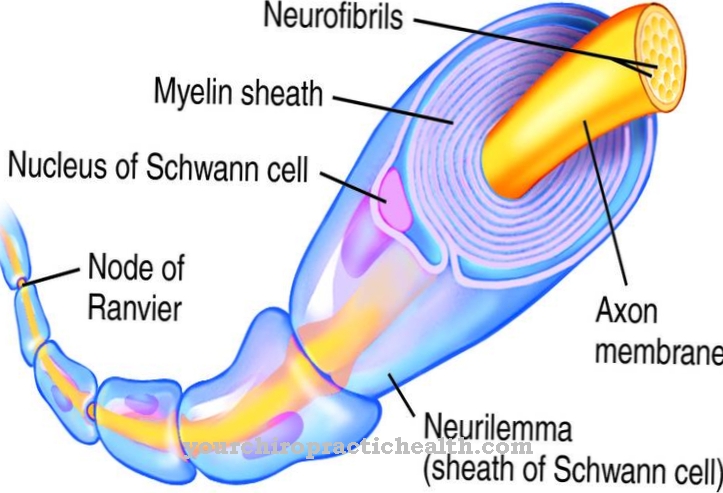
Міозини можна розділити на різні класи та підкласи. Наразі відомо понад 18 різних класів, найбільш важливими є класи I, II та V. Міозин, знайдений у м’язовій клітковині, називається звичайним міозином і належить до класу II.Структура всіх міозинів схожа. Всі вони складаються з частини голови (головка міозину), частини шиї та частини хвоста.
Міозинові нитки скелетного м’яза складаються з приблизно 200 молекул міозину II, кожна з молекулярною масою 500 кДа. Узголів’я ліжка генетично дуже консервативне. Поділ на структурні класи в основному визначається генетичною мінливістю хвостової частини. Голова частина зв’язується з молекулою актину, в той час як частина шиї діє як шарнір. Хвостові частини декількох молекул міозину накопичуються і утворюють нитки (пучки). Молекула міозину II складається з двох важких і чотирьох легких ланцюгів.
Дві важкі ланцюги утворюють так званий димер. Більш довгий з двох ланцюгів має альфа-спіральну структуру і складається з 1300 амінокислот. Коротша ланцюг складається з 800 амінокислот і являє собою так званий моторний домен, який утворює головну частину молекули, яка відповідає за рух і транспортні процеси. Чотири легких ланцюга з'єднані з головою і шиєю важких ланцюгів. Легкі ланцюги, розташовані далі від голови, називаються регулюючими, а легкі ланцюги, розташовані близько до голови, як необхідні ланцюги. Вони дуже споріднені до кальцію і, таким чином, можуть контролювати рухливість частини шиї.
Функція та завдання
Найважливіша функція всіх міозинів - транспортувати клітинні органели в еукаріотичних клітинах та здійснювати зрушення всередині цитоскелету. Звичайні молекули міозину II разом з актином та білками тропоміозином та тропоніном відповідають за скорочення м'язів. Для цього міозин спочатку інтегрується в Z-диски сакомера за допомогою білка титин. Шість титинових ниток фіксують міозинову нитку.
У сакомері міозинова нитка утворює близько 100 поперечних з’єднань у сторони. Залежно від структури молекул міозину та вмісту міоглобіну можна виділити кілька форм м’язових волокон. Скорочення м'язів відбувається в межах сакомеру через рух міозину в крос-мостовому циклі. Перш за все, головка міозину міцно прикріплена до молекули актину. Потім АТФ розщеплюється на АДФ, завдяки чому вивільняється енергія призводить до напруги головки міозину. У той же час легкі ланцюги забезпечують збільшення іонів кальцію. Це призводить до того, що головка міозину приєднується до сусідньої молекули актину в результаті конформаційної зміни.
Вивільнивши старе з'єднання, натяг тепер перетворюється на механічну енергію завдяки так званому силовому удару. Рух схожий з ударом весла. Голова міозину нахиляється від 90 градусів до 40 - 50 градусів. Результат - рух м’язів. Під час скорочення м’язів скорочується лише довжина сакомера, тоді як довжина ниток актину та міозину залишається однаковою. Подача АТФ у м'яз достатня лише на три секунди. Розщеплюючи глюкозу та жир, АДФ перетворюється назад в АТФ, так що хімічна енергія все ще може перетворюватися в механічну енергію.
Хвороби
Структурні зміни міозину, викликані мутаціями, можуть призвести до захворювань м’язів. Прикладом такого захворювання є сімейна гіпертрофічна кардіоміопатія. Родинна гіпертрофічна кардіоміопатія - спадкове захворювання, яке успадковується як аутосомно-домінантний ознака. Хвороба характеризується потовщенням лівого шлуночка без розширення.
З поширеністю 0,2 відсотка серед загальної популяції це відносно поширені захворювання серця. Це захворювання викликане мутаціями, які призводять до структурних змін бетаміозину та альфатропоміозину. Це не одна, а кілька точкових мутацій білків, що беруть участь у структурі сакомера. Більшість мутацій розташовані на хромосомі 14. Патологічно захворювання проявляється потовщенням м’язів лівого шлуночка.
Ця асиметрія в товщі міокарда може призвести до серцево-судинних скарг із серцевою аритмією, задишкою, запамороченням, втратою свідомості та стенокардією. Незважаючи на те, що у багатьох пацієнтів мало або зовсім немає порушення їх серцевої функції, може розвинутися прогресуюча серцева недостатність.


.jpg)




.jpg)
.jpg)



.jpg)