The Індукований-підходить-Теорія повертається до Кошленду і відповідає розширенню принципу блокування ключа, який ґрунтується на точності прилягання анатомічних структур. Індукована придатність відноситься до ферментів, таких як кіназа, які змінюють свою конформацію з утворенням комплексу ферментів-ліганду. У разі дефектів ферментів, на порушення індукованого принципу можуть впливати порушення.
Що таке індукований придатний?

Багато процесів в кузові працюють за принципом замикання ключа або рукавички. Це стосується, наприклад, шарнірних з'єднань. Голова суглоба зачіпається в розетці суглоба, як ключ у замку або рука в рукавичці. Двері відкриваються лише тоді, коли ключ знаходиться точно в замці. У цьому ж контексті певні функції організму відкриваються лише тоді, коли структури точно відповідають.
Індукована підгонка - це особлива форма принципу "ключ-замок". Це теорія утворення білково-лігандних комплексів, наприклад, фермент-субстратний комплекс в контексті реакцій, що каталізуються ферментами.
Даніель Е. Кошланд вважається першим, хто описав цю теорію і вперше постулював її в 1958 році. На відміну від принципу блокування ключа, теорія індукованого пристосування не передбачає двох статичних структур. Зокрема, у випадку білково-лігандних комплексів конформаційна зміна білка, що бере участь, повинна дати можливість комплексу формуватися. Ліганд і білок, а точніше фермент, Кошланд розглядав як динамічний і говорив про взаємодію, яка рухає обох партнерів до зміни конформації заради утворення комплексу.
Функція та завдання
Існує специфічність зв'язування між ферментами та субстратами. Ця специфіка прив’язки передбачає принцип блокування ключа. Кожен фермент має активний центр. Для складного утворення з лігандом цей центр точно формується таким чином, що він майже ідеально відповідає просторовій формі передбачуваної підкладки.
Що стосується багатьох ферментів, то активний центр у кожному випадку знаходиться у формі, не дуже точній, доки він не пов'язаний із субстратом. Це спостереження, здається, суперечить принципу "ключ-ключ", оскільки ферменти та їх ліганди спочатку, здається, адаптують свою форму.
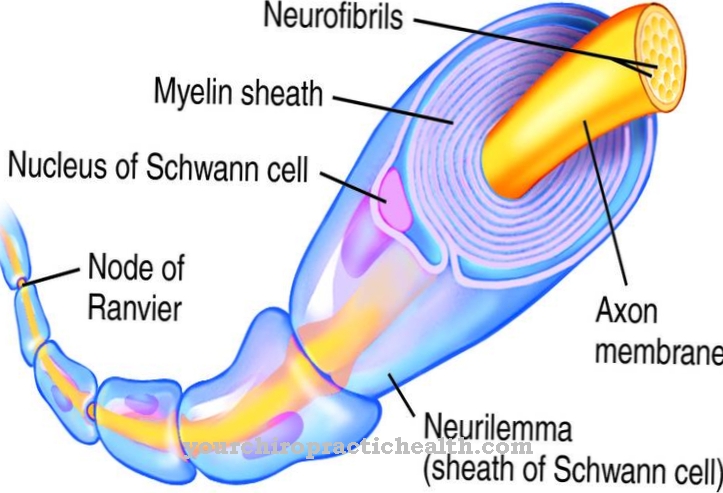
Як тільки фермент приєднається до ліганду, створюються міжмолекулярні взаємодії. Ці взаємодії на міжмолекулярному рівні призводять до зміни конформації ферменту. Під конформацією розуміють різні можливі розташування окремих атомів у молекулі, що є результатом простого обертання навколо осі. Зміна конформації ферментів відповідає зміні просторового розташування їх молекул і лише дає можливість утворення ферментно-субстратного комплексу.
Гексокіназа як ферменти каталізує, наприклад, першу стадію гліколізу. Як тільки ці ферменти контактують із субстратом глюкозою, може спостерігатися індуковане пристосування у сенсі утворення «індукованої форми». Фермент гексокіназа фосфорилює його ліганд-глюкозу, споживаючи АТФ для утворення глюкозо-6-фосфату.
Структура води нагадує ту, що знаходиться в алкогольній групі атома С6, який фермент фосфорилює під час реакції. Через малі розміри молекули води могли приєднатися до активного центру ферменту, щоб утворився гідроліз АТФ. Однак індуковане пристосування дозволяє гексокіназі каталізувати перетворення глюкози з високою специфічністю, так що гідроліз АТФ повинен мати місце в незначній мірі. З механізмом індукованого прилягання специфічність підкладки збільшується.
Принцип всередині людського організму можна дотримуватися, особливо у випадку кіназ. Індукована адаптація не стосується кожного комплексу ліганд-рецепторів, оскільки конформаційна зміна обох партнерів у багатьох випадках є природними межами.
Хвороби та недуги
Принцип індукованого пристосування порушується у випадку різних дефектів ферментів. Наприклад, при фенілкетонурії ензими обмежені у своїй активності або повністю виходять з ладу. Зазвичай це пов’язано з генетичним дефектом. При фенілкетонурії фермент фенілаланін гідроксилаза є дефектним. Фенілаланін більше не перетворюється на тирозин і накопичується відповідно. Нейротоксичні речовини виникають, так що крім психічних відхилень у пацієнта спостерігається схильність до спазмів. Дефекти ферментів, як правило, генетичні і викликані неправильно кодованою послідовністю амінокислот у ДНК.
Метаболічні захворювання, спричинені дефектами ферментів та таким принципом порушеного пристосування, відомі як ензимопатії. Дефекти піруваткінази присутні, наприклад, у неправильно кодуючому гені PKLR. Цей ген розташований на локусі гена 1q22 хромосоми 1. Відомі різні мутації аллеля PKLR піруваткінази, які виявляються у вигляді дефектів у формі R.
Хворобу Герса знову називають глікогенозом VI типу і належить до групи захворювань зберігання глікогену. Це аутосомно-рецесивний або Х-пов'язаний метаболічний розлад через дефекти ферментів. Точніше, причина полягає в різних дефектах ферментів у системі фосфорилази-кінази всередині печінки та м’язів. У цьому контексті, наприклад, відомий дефект фосфорилази-b-кінази, пов'язаний з X, у печінці, дефект фосфорилази печінки аутосомно-рецесивного спадку та комбінований збій фосфорилази-b-кінази в печінці та м’язах.
У зв'язку з фосфорилазою печінки причинні мутації були локалізовані на гені PYGL і тому знаходяться на хромосомі 14q21 до q22. Комбінований дефіцит фосфорилази м'язів печінки пов'язаний з мутаціями гена PHKB в локусі 16q12-q13. Причинно-наслідкові мутації в гені PHKA2 на локусі Xp22.2-p22.1 були виявлені за X-зв'язаним дефектом фосфорилази-кінази печінки. Інші глікогенози також можуть скасувати індукований ефект придатності відповідної кінази або ускладнити її.









.jpg)
.jpg)



.jpg)