The Альдегід оксидаза є ферментом, який розщеплює альдегіди у хребетних. Його можна знайти в різних тканинах ссавців і людини. Точна функція альдегідоксидази ще не відома.
Що таке альдегід оксидаза?
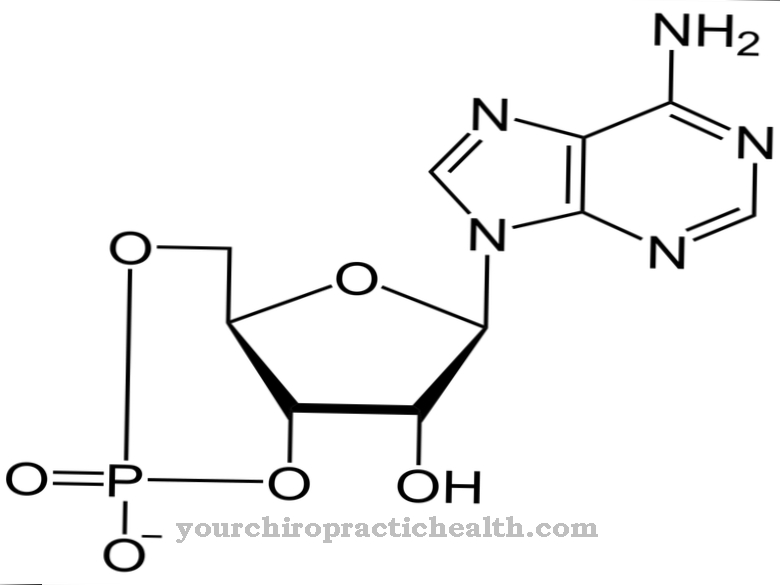
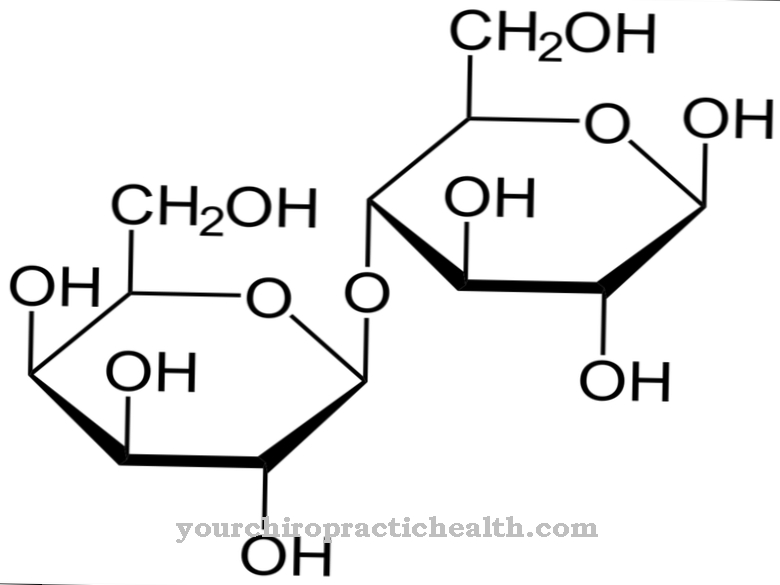
Альдегід оксидаза (AOX1) допомагає при ферментативному розщепленні альдегідів в організмі. Однак було встановлено, що він також розщеплює нікотин на котинін. Атом кисню вбудований в нікетин, що не містить кисню, щоб утворити альдегідну структуру.
Завдяки цьому факту альдегідна оксидаза також важлива для метаболізму триптофану і водночас для біотрансформації. В основному він міститься в цитозолі клітин печінки, підшлункової залози, легенів, скелетних м’язів або жирових клітин. Кофактор молібден дуже важливий для активності ферменту. У ДНК людини існує лише один ген AOX, який може кодувати функціональний фермент. Кілька генів AOX активні в інших хребетних. Альдегід оксидаза дуже схожа на фермент ксантиндегідрогеназа та пов'язана з нею.
Обидва ферменти можуть перетворювати гіпоксантин у ксантин, поглинаючи атом кисню та молекулу води. Перетворення ксантину в сечову кислоту, проте, відбувається лише через ксантин гідрогеназу (ксантиноксидаза). Оксидаза альдегід складається з 1338 амінокислот. Молібдоптерин, FAD і 2 (2Fe2S) є кофакторами для їх ефективності. Реакція, яка вже характеризується назвою, характеризує перетворення альдегідів з додаванням кисню та води до карбонових кислот та перекису водню.
Функція, ефект та завдання
Фермент альдегід оксидаза каталізує кілька реакцій. Здебільшого він відповідає за перетворення альдегідів у карбонові кислоти з додаванням кисню та води. Взагалі альдегід оксидаза опосередковує додавання атома кисню до субстрату.
Крім усього іншого, він також каталізує перетворення нікотину в контитин. Тому він також відіграє головну роль у біотрансформації та обміні триптофану. Молібден завжди необхідний як кофактор у цих реакціях. У рамках біотрансформації він перетворює ксенобіотики з альдегідними групами у відповідні карбонові кислоти у реакції фази I. В реакції II фази глюкуронова кислота приєднується до карбоксильних груп для підвищення розчинності у воді з метою виведення чужорідної молекули з організму.
Структурно та хімічно альдегід оксидаза тісно пов'язана з гомологічним ферментом ксантин гідрогеназою (ксантиноксидаза). Однак невідомо, чому перетворення ксантину в сечову кислоту з додаванням кисню та води каталізується лише ксантиноксидазою. Перетворення гіпоксантину в ксантин все ще каталізується обома ферментами. Крім того, альдегід оксидаза також відповідає за адипогенез (розмноження жирових клітин).
Він стимулює секрецію тканинного гормону адипонектину. Адіпонектин, у свою чергу, підвищує ефективність інсуліну. У гепатоцитах адипонектин, в свою чергу, гальмує вивільнення альдегідоксидази. Дефіцит альдегідоксидази (AOX1) також гальмує експорт ліпідів з клітин. Точна функція альдегідоксидази ще не повністю з'ясована.
Освіта, виникнення, властивості та оптимальні значення
Альдегід оксидаза в основному міститься в цитоплазмі клітин печінки. Однак він також міститься в жирових клітинах, тканинах легенів, скелетних м’язах, підшлунковій залозі. Раніше його плутали з гомологічною ксантиноксидазою.
Обидва ферменти мають схожу будову. Однак вони іноді каталізують різні реакції. Обидва ферменти потребують однакових кофакторів для своєї функції. Це молібдоптерин, FAD та 2 (2Fe2S). Однак альдегід оксидаза не тільки руйнує альдегід, але також відповідає за окислення N-гетероциклічних сполук, таких як нікотин до котиніну.
Хвороби та розлади
Разом з ксантиндегідрогеназою (ксантиноксидазою) та сульфіт оксидазою альдегідоксидаза залежить від молібдену кофактора. Молібден вбудований у молібдоптерин як складний атом і утворює кофактор молібдену. У разі дефіциту молібдену ці три ферменти погано функціонують.
Ксантиндегідрогеназа каталізує розпад ксантину на сечову кислоту. Фермент альдегід оксидаза лише частково бере участь у цьому процесі, наприклад, коли гіпоксантин розпадається на ксантин. Тут він навіть конкурує з ксантиноксидазою. Отже, не існує ізольованого дефіциту альдегідоксидази. Однак альдегід оксидаза підтримує розпад катехоламінів. Сульфітна оксидаза відповідає за розпад сірковмісних амінокислот, таких як цистеїн, таурин або метіонін. Якщо цей фермент має дефіцит, сульфіт більше не перетворюється на сульфат. Через молібден кофактора три ферменти зазвичай мають загальний дефіцит.
Звичайно, можливі поодинокі дефекти через мутації для кожного з цих ферментів. Однак поки що не описана клінічна картина із специфічним дефіцитом альдегід оксидази. Дефіцит молібдену, викликаний незбалансованою дієтою, зустрічається дуже рідко. Однак це може статися при парентеральному харчуванні, яке має низький вміст молібдену більше шести місяців. У таких випадках часто зустрічаються тахіпное, тахікардія, сильний головний біль, нудота, блювання, центральна непрохідність обличчя або кома. Крім того, є непереносимість певних амінокислот. Підвищені концентрації сульфіту виявляються в сечі, тоді як знижені значення сечової кислоти в крові.
Якщо дефіцит молібдену зберігається, це може призвести до проблем з руйнуванням амінокислот, що містять сірку, алергії на сульфіт, випадання волосся, низького рівня сечової кислоти в крові та проблем з фертильністю. Однак більшість симптомів обумовлені дефіцитом сульфіт-оксидази та ксантиндегідрогенази. Тахікардія, ймовірно, обумовлена підвищенням рівня адреналіну або норадреналіну (катехоламінів), оскільки їх розпад затримується через брак альдегідоксидази. Дефіцит молібдену може бути спричинений дієтою, в якій вкрай мало молібдену, та запальними захворюваннями кишечника, такими як хвороба Крона з мальабсорбцією їжі.
Спадковий дефіцит кофактора молібдену через порушення синтезу молібдоптерину є смертельним, якщо всі три ферменти не піддаються лікуванню.



.jpg)
.jpg)




-eisenmangelanmie.jpg)